Evoluční historie fotosyntézy
- Autor: Roman Sobotka, Josef Komenda
- Vyšlo v časopise Živa 4/2025 na straně 148
Oxygenní fotosyntéza, která je dominantním typem metabolismu na naší planetě, je založená na souhře dvojice světlem poháněných enzymů nazývaných fotosystémy a vyžaduje barvivo chlorofyl. Určité skupiny bakterií nicméně používají i jednodušší formy (anoxygenní) fotosyntézy, která si postačí pouze s jedním fotosystémem a využívá odlišné barvivo bakteriochlorofyl. Logicky se přepokládalo, že z evolučního hlediska je anoxygenní fotosyntéza starší než oxygenní, ale moderní metody fylogenetiky a strukturní biologie nyní naznačují velmi odlišný scénář.
Použitá literatura
XIE, Hao, et al. Cryo-EM structure of the whole photosynthetic reaction center apparatus from the green sulfur bacterium Chlorobaculum tepidum. Proceedings of the National Academy of Sciences, 2023, 120.5: e2216734120.
SÁNCHEZ‐BARACALDO, Patricia; CARDONA, Tanai. On the origin of oxygenic photosynthesis and Cyanobacteria. New Phytologist, 2020, 225.4: 1440-1446.
OLIVER, Thomas, et al. The evolution and evolvability of photosystem II. Annual Review of Plant Biology, 2023, 74.1: 225-257.
Oxygenic photosynthesis, the dominant type of metabolism on our planet, is based on the interplay of a pair of light-driven enzymes called photosystems and requires the pigment chlorophyll. However, certain groups of bacteria also use a simpler form of (anoxygenic) photosynthesis requiring only one photosystem and another pigment, bacteriochlorophyll. It was logically assumed that, in evolution, anoxygenic photosynthesis preceded the oxygenic form, but modern methods of phylogenetics and structural biology now provide a completely different scenario.
Obrazové přílohy
-
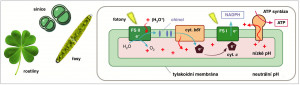
Oxygenní fotosyntéza vyžaduje spolupráci dvojice enzymů poháněných světlem (fotosystémů FS I a FS II), které jsou spolu s dalšími enzymy – cytochromem (cyt.) b6f a adenosintrifosfát (ATP) syntázou – ukotvené ve specializované vnitřní tylakoidní membráně. U řas a vyšších rostlin je tato membrána součástí chloroplastů. FS II dokáže získat z molekul vody elektrony, které jsou poté přeneseny, spolu s protonem z cytoplazmy, na chinol. Tato molekula je následně oxidována (je odebrán elektron) cytochromem b6f a proton uvolněn do prostoru uvnitř tylakoidní membrány. Výsledný protonový gradient pohání enzym ATP syntázu. Cytochrom b6f přenese elektron na cytochrom c a tento elektron je nakonec využit enzymem FS I na syntézu nikotinamid adenindinukleotidfosfátu (NADPH). Orig. R. Sobotka
-
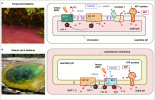
Purpurové bakterie (a) obsahují vnitřní membrány zvané chromofory, kde se nachází fotosyntetický aparát. Reakční centrum typu II (RC II) je enzym poháněný fotony infračervené části spektra (Near-Infrared, NIR). Jeho funkcí je získat elektrony z cytochromu c a přenést je na chinol podobně jako FS II komplex. Cytochrom bc funguje identicky jako cytochrom b6f. NADH, a v dalším kroku NADPH – redukovaná forma NADH s navázanou fosfátovou skupinou, je produkován respiračním komplexem I, který odebírá elektrony z chinolu za spotřeby protonového gradientu. Zelené sirné bakterie (b, foto Vulturesong, Wikimedia Commons) obsahují reakční centrum typu I (RC I), které oxiduje sirovodík (H2S) pomocí ukotveného cytochromu cz, ale oxidován může být také cytochrom c. Získané elektrony je tento komplex schopný přenést jak na NADPH, tak na chinol. Následná aktivita cytochromu bc zajišťuje protonový gradient pro tvorbu ATP. Orig. a foto (a) R. Sobotka
-
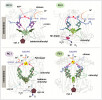
Porovnání uspořádání vnitřních kofaktorů – pigmentů, atomu železa, uskupení železnatých a sirných iontů (FeS klastrů) a manganových (Mn) klastrů – u jednotlivých typů reakčních center. Přenos elektronů uvnitř každého centra naznačuje červená šipka. V případě RC II a FS II je chinol uvolněn do membrány a následně navázána další molekula chinonu. Chinony v FS I jsou vázány pevně a slouží pouze pro přenos elektronů na FeS klastr. Orig. R. Sobotka
-
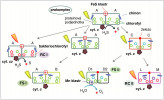
Model evoluce jednotlivých typů reakčních center z původního prakomplexu. Výchozí komplex se skládal ze dvou identických proteinových podjednotek „A“, obsahoval chlorofyl, FeS klastr a interagoval pouze slabě s molekulami chinonu. Prakomplex byl nicméně poměrně univerzální, schopný oxidovat jak cytochrom c, tak další zdroje elektronů jako H2S. Hypotetický homodimerní předchůdce FS II a RC II komplexů byl již specializovaný na přenos elektronů z cytochromu c na chinon, zatímco homodimerní předchůdce FS I zodpovídal za produkci NADPH. Orig. R. Sobotka
Archiv článků pro pedagogy a studenty
Předplatné Živy
Cena ročního předplatného
od čísla 1/2019 je 354 Kč za šest čísel Živy (tedy 59 Kč za jedno číslo).
Dvouleté předplatné je zrušeno.
Zjistěte, jak si předplatit časopis Živa.
Co je to Živa?
Časopis Živa je populárně vědecký časopis přinášející příspěvky z biologických oborů a zvláštní rubriku věnovanou výuce biologie se zaměřením na nejnovější poznatky.
Navazuje na odkaz svého zakladatele Jana Evangelisty Purkyně. Poslední řada vychází nepřetržitě od roku 1953.





